Négligence spatiale unilatérale
Introduction
La négligence spatiale unilatérale (NSU) est une des atteintes les plus invalidantes de l’AVC, qui se définit comme l’incapacité à prendre en compte des stimuli venant de l’hémi-espace opposé à la lésion cérébrale. En clinique, la présence d’une NSU sévère apparaît lorsqu’un patient entre en collision avec son environnement, ignore les aliments qui se trouvent d’un côté de son assiette et ne s’occupe que d’un seul côté de son corps. De nombreux termes sont employés de façon interchangeable dans la littérature pour décrire la NSU : négligence unilatérale, hémi-inattention, négligence visuelle et négligence hémi-spatiale. On estime que jusqu’à 30 % de patients ont une NSU après un AVC.
Un client atteint de NSU est incapable de s’occuper d’un côté de son corps (négligence personnelle), de l’espace dans la distance pour l’atteinte (négligence de l’hémi-espace extrapersonnel proche), de l’espace au-delà de la distance d’atteinte (négligence de l’hémi-espace extrapersonnel lointain), ou une combinaison de ces trois espaces dans l’environnement. La NSU continue d’être couramment associée à un AVC de l’hémisphère droit, mais les preuves tirées de la littérature laissent entendre que tous les patients ayant subi un AVC pourraient tirer parti d’un dépistage de la NSU.
La présence d’une NSU a été fortement associée à un risque accru de blessure et à des résultats fonctionnels faibles. Les effets d’une NSU vont au-delà des habiletés de bases des soins personnels (hygiène, habillage, marche, etc.) et s’étendent aux activités instrumentales de la vie quotidienne (AIVQ) qui sont cruciales pour une bonne réintégration dans la vie communautaire.
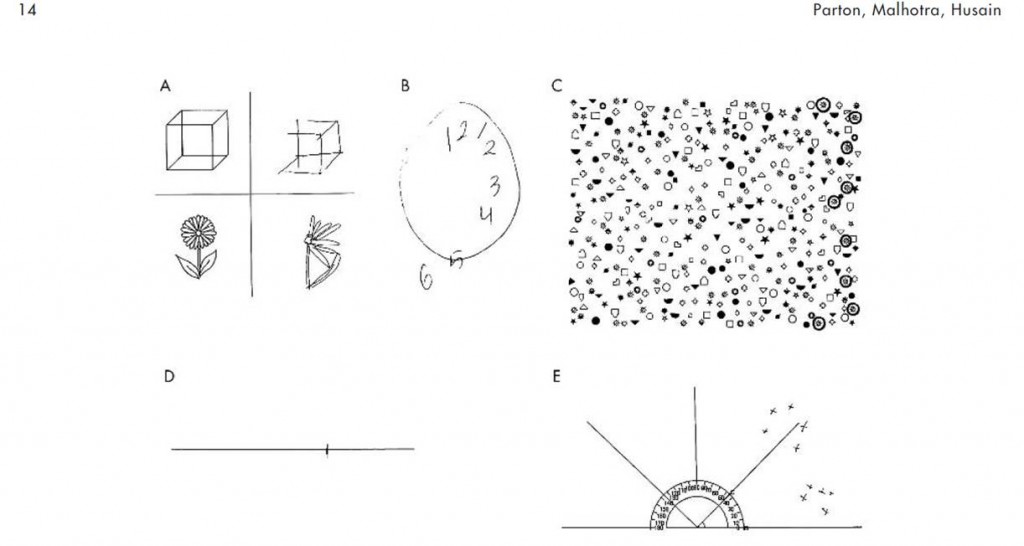
En référant à l’image ici-bas « Typiquement, les patients avec un AVC de l’hémisphère droit avec une négligence à gauche omettent les éléments à leur gauche lors de la copie d’objets simples (A), lors du dessin d’une d’horloge (B), et lors de l’annulation de cibles à travers des distracteurs (C). Ils ont aussi tendance à décaler vers la droite lorsqu’on leur demande de couper en deux une ligne horizontale (D). Lorsqu’on leur demande de nommer les objets dans leur environnement, ils auront tendance à ne nommer que ceux à leur droite. Les croix (E) indiquent l’emplacement des objets nommés en rapport à eux. » (page 14 de Parton, A et al. J Neurol Neurosurg Psychiatry 2004; 75:13-21 reproduit avec la permission de BMJ Publishing Group, traduction libre).
Information aux patients/familles
Qu’est-ce que la négligence spatiale unilatérale (NSU) ?
La négligence spatiale unilatérale est l’incapacité de faire attention aux gens et aux objets du côté qui a été affecté par un AVC. Par exemple, une personne présentant une paralysie du côté gauche peut aussi avoir une NSU du côté gauche. Ce problème s’appelle aussi parfois négligence visuelle unilatérale.
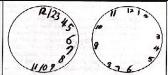
Représentation du test du dessin d’horloge par une personne normale (à droite) et par un patient ayant une négligence du côté gauche (à gauche)
Les patients qui ont une NSU sévère présentent des symptômes évidents; ils peuvent :
- Entrer en collision avec leur entourage, par un côté (en général le côté gauche) quand ils essaient de manœuvrer un fauteuil roulant,
- Ignorer les aliments qui se trouvent d’un côté de leur assiette, en général le côté gauche,
- Ignorer un côté de leur corps, en général le côté gauche.
Par exemple, vous remarquerez peut-être qu’une personne ayant une NSU ne se rase que d’un seul côté du visage, en général le côté droit, et ignore le côté gauche.
Les membres de la famille sont souvent frustrés les premiers jours après l’AVC, car ils ne comprennent pas pourquoi le patient ne les regarde pas quand ils se trouvent du côté affecté par l’AVC. Ce n’est pas que la personne les ignore, mais elle n’est pas consciente de ce côté.
Un patient peut aussi avoir de légers symptômes de NSU qui ne sont pas évidents. Par exemple, il peut être capable de remarquer les aliments qui se trouvent du côté droit et du côté gauche, et peut vous regarder si vous vous trouvez de son côté affecté, mais il peut avoir de la difficulté à exécuter des tâches plus complexes de la vie quotidienne, comme conduire une voiture ou traverser une rue passante.
Étant donné que la NSU peut entraîner des chutes et d’autres problèmes dans le cours des activités de la vie quotidienne, et parce qu’il est possible de la traiter, il est important que tous les patients ayant eu un AVC reçoivent au moins une évaluation rapide pour tester leur NSU.
La NSU est-elle fréquente après un AVC ?
Environ 30 % des patients ont soit une hémianopsie (cécité d’un côté des deux yeux), soit une NSU après un AVC. La NSU est plus souvent présente chez les personnes qui ont eu un AVC du côté droit du cerveau. Toutefois, des études montrent que tous les patients ayant eu un AVC doivent subir des tests pour la NSU. La NSU peut survenir de trois façons :
- une personne peut avoir une NSU qui donne lieu à une négligence d’un seul côté du corps. Par exemple, vous verrez peut-être une personne dont la main pend hors du fauteuil roulant dans les rayons de la roue, mais qui ne s’en rend pas compte.
- une personne peut avoir une NSU de l’espace dans la distance pour atteindre un objet. Par exemple, vous verrez peut-être que la personne ne sait pas où est le téléphone, même quand il est assez proche, parce qu’il se trouve du côté affecté par l’AVC.
- une personne peut avoir une NSU dans l’espace au-delà de la distance d’atteinte. Ce type de NSU est souvent omis pendant que le patient est à l’hôpital. Mais, c’est un problème sérieux, car quand la personne marche et conduit, elle n’a pas les informations visuelles importantes d’une moitié de son environnement.
La négligence peut survenir de l’une de ces trois façons ou en une combinaison de celles-ci.
Quelles sont les conséquences potentielles d’une NSU après un AVC ?
Les personnes qui ont une NSU ont plus de risque de faire une chute et ont en général une capacité fonctionnelle moindre que celles qui n’ont pas de NSU. La NSU peut affecter la capacité de s’occuper de soi, comme pour le bain, l’habillement et la marche.
La NSU provoquée par un AVC peut-elle être traitée ?
Il y a quatre types de traitement pour la NSU :
- L’exploration visuelle : Pendant ce traitement, la personne présentant une NSU est encouragée à explorer le champ visuel négligé (en général le côté gauche) en exécutant une tâche de ce côté. Le traitement comprend souvent une cible visuelle que le patient utilise comme point de fixation pendant l’exploration.
- La stimulation sensorielle : Le thérapeute utilise différents types de stimulation sensorielle pour encourager la personne à faire attention à son côté négligé, entre autres :
- Les indices visuels/verbaux/auditifs : L’utilisation d’un indice visuel (p. ex. l’utilisation de ruban adhésif rouge ou de lumières clignotantes), d’un indice verbal (p. ex. la voix du thérapeute ou d’un membre de la famille) ou d’un indice auditif (p. ex. un avertisseur sonore ou une cloche) du côté négligé pour améliorer la prise de conscience de cet espace.
- Activation d’un membre : Quand il exécute ce traitement, le patient fait des mouvements avec le bras et la main affectés du côté négligé pour encourager l’exploration visuelle de cet espace (en général la main et le bras gauches vers la gauche). La personne recevant le traitement peut faire ces mouvements seule ou avec l’aide du thérapeute.
- Stimulation calorique : Ce traitement utilise de l’eau froide ou chaude que l’on met dans l’oreille du patient (canal de l’oreille externe) pour encourager l’exploration du côté négligé. L’eau froide semble encourager l’exploration vers l’oreille stimulée. L’eau chaude encourage l’exploration du champ opposé à l’oreille stimulée.
- Cache-œil/hémilunettes : Ce traitement utilise des lunettes standard avec la moitié des deux verres noircis du même côté (en général la moitié droite). Cela force le patient à regarder par le verre qui représente le côté qu’il néglige (en général le côté gauche).
- Prismes de Fresnel : Ce traitement implique de mettre des prismes sur des lunettes normales. Les prismes provoquent une déviation du champ visuel. Donc, s’il y a négligence du côté droit, ces prismes décaleront encore plus à droite ce que le patient voit à droite afin d’encourager l’exploration visuelle du champ visuel droit. Quand le patient porte ces lunettes pour la première fois, il n’atteint pas les objets du côté droit parce que sa vision est déviée vers la droite. Après des traitements répétés, les clients peuvent corriger la distance d’atteinte et peuvent saisir avec précision l’objet, en dépit de l’information visuelle déformée qu’ils reçoivent avec leurs lunettes.
- Vibrations ou stimulation nuque/main : Cette intervention consiste en l’utilisation de vibrations ou de stimulation sur la nuque ou la main du côté affecté par l’AVC pour encourager le patient à regarder de ce côté-là.
- Rotations du tronc : Cette stratégie implique des rotations volontaires du tronc vers le côté affecté par la NSU pour améliorer l’exploration visuelle de cet espace.
- Imagerie visuomotrice : L’imagerie visuelle implique des tâches d’imagerie mentale au cours desquelles le patient doit décrire les détails d’une pièce, d’un milieu ou d’une région géographique qui lui sont familiers. L’imagerie motrice consiste pour le patient à imaginer un mouvement corporel ou une posture et à décrire cette séquence. Ce type de traitement par imagerie peut stimuler les zones du cerveau qui peuvent activer ces mouvements réels pendant les activités de la vie quotidienne afin d’améliorer les symptômes de négligence.
- La thérapie par contrainte induite : Ce traitement implique de restreindre le bras qui n’est pas affecté par l’AVC (par exemple avec une écharpe) pour encourager l’utilisation du bras affecté par l’AVC. Tandis que cette intervention est utilisée surtout pour encourager l’utilisation du bras, elle encouragera aussi l’exploration visuelle du côté utilisé.
- Stimulation optocinétique : Observation de cibles visuelles mobiles de gauche à droite. Ce traitement est utilisé pour encourager l’exploration visuelle du côté qui est négligé. Voir ici pour un exemple.
- Rétroaction vidéo : Ce traitement implique de filmer le patient pendant qu’il exécute des activités spécifiques. Le thérapeute et le patient regardent ensuite le vidéo ensemble. Le thérapeute fait remarquer au client à quel point il néglige son corps ou l’espace d’un côté de son corps. Ils discutent ensuite des stratégies pour encourager l’attention vis-à-vis du corps du patient et de l’espace qu’il néglige.
- Thérapie pharmacologique : Ceci implique l’utilisation de médicaments spécifiques (médicaments agonistes de la dopamine) pour améliorer les compétences d’attention visuelle. Un médecin doit prescrire ces médicaments.
Quel traitement fonctionne pour la NSU ?
Les avantages des diverses interventions pour traiter les symptômes de la NSU ont été étudiés avec soin chez les personnes ayant subi un AVC. Des études de recherche ont signalé que l’utilisation de l’exploration visuelle, l’activation du membre, les rotations du tronc ainsi que les indices (visuels, verbaux, auditifs) pendant le traitement ont mené à des améliorations des symptômes de la NSU et dans certains cas, à des améliorations dans l’exécution des activités de la vie quotidienne. Les patients recevant un traitement avec un cache-œil et des prismes ont aussi montré des progrès en ce qui concerne l’attention accordée au côté négligé; toutefois, ces avantages n’étaient présents que pendant le traitement et ils se sont estompés rapidement après. Les autres traitements décrits dans la section ci-dessus exigent d’autres recherches pour déterminer s’ils sont efficaces.
Qui offre ce traitement ?
Les ergothérapeutes offrent en général ce traitement pour la NSU dans un hôpital de soins aigus, un centre de réadaptation ou une clinique privée.
Information aux cliniciens
L’efficacité de différentes interventions dans la gestion de la Négligence spatiale unilatérale (NSU) a été examiné avec des individus ayant subi un AVC. Les résultats de plusieurs études au sujet de la NSU sont compilés dans ce module, incluant 16 ECR de haute qualité, 14 ECR de qualité acceptable, quatre ECR de faible qualité, et plusieurs études non randomisées qui évaluent les avantages des différentes interventions dans le traitement de la NSU. L’information est regroupée en fonction du temps qui s’est écoulé depuis l’AVC ainsi que et le type d’intervention utilisé.
Tableau des résultats
Pour visualiser le tableau des résultats par auteurs (anglais seulement)Résultats
Phase aiguë
Phase subaiguë
Phase chronique
Phase de récupération non spécifique à une période
Comment faire - clinicien
Module d’apprentissage en ligne de la Négligence spatiale unilatérale (NSU)
Veuillez consulter notre Module d’apprentissage en ligne sur la NSU : http://elearning.strokengine.org/module.php
Qu’est-ce que la NSU ?
La NSU (négligence spatiale unilatérale) se caractérise le plus souvent par l’incapacité à s’orienter ou à répondre aux stimuli apparaissant sur le côté/hémi-espace controlatéral de la lésion cérébrale. Des termes tels que négligence unilatérale, hémi-inattention, négligence visuelle et négligence hémi-spatiale sont utilisés pour décrire la NSU. Plus de 30 % des patients auront une NSU post-AVC. La NSU est plus fréquente chez les personnes ayant subi un AVC dans l’hémisphère droit, de sorte que les symptômes de la NSU apparaissent généralement dans l’hémisphère gauche. Des recherches ont démontré que les lésions des zones cérébrales suivantes conduisent à une NSU : la jonction pariéto-temporale droite, le gyrus angulaire, le lobe pariétal inférieur droit, la région parahippocampique et le cortex temporal supérieur droit. Selon la zone du cerveau affectée, il existe trois types différents de NSU et les patients peuvent présenter l’un de ces trois types ou une combinaison de ces derniers avec des degrés de sévérité variables :
Négligence personnelle : Négligence d’un côté du corps (par exemple, les patients se rasent ou se maquillent sur la moitié du visage, généralement la moitié gauche) ; acquise à la suite d’une lésion du lobe pariétal (gyrus post-central et supramarginal) ;
Négligence de l’hémi-espace extra-personnel rapproché : Négligence de l’environnement à portée de main (par exemple, les patients ignorent la nourriture sur un côté de l’assiette, généralement la moitié gauche) ;
Négligence de l’hémi-espace extra-personnel lointain : Négligence de l’espace au-delà de la portée de main (par exemple, les patients se heurtent à leur environnement, généralement la gauche, lorsqu’ils essaient de se déplacer en fauteuil roulant).
*La négligence extra-personnelle résulte de lésions du lobe frontal (prémotrice ventrale et cortex préfrontal dorsolatéral) et du lobe temporal (gyrus temporal moyen et supérieur antérieur, et sillon temporal supérieur).
Pourquoi est-il essentiel d’être évalué pour la NSU ?
Les patients atteints de NSU courent un risque accru de chutes et de blessures afférentes, et ont généralement des séjours de réadaptation plus longs ainsi qu’une récupération fonctionnelle moins bonne suite à l’AVC. Étant donné que la NSU peut entraîner des chutes et un manque d’autonomie dans les activités quotidiennes, et qu’elle est traitable, tous les patients doivent être rapidement dépistés ou évalués pour la NSU pendant la phase aiguë suivant l’AVC. Les patients chez qui la présence de NSU a été décelée doivent bénéficier d’interventions efficaces visant à réduire les déficits et à maximiser les fonctions.
Qui doit être évalué ?
Les déficits de perception, y compris la NSU, sont plus fréquents chez les personnes souffrant de lésions de l’hémisphère droit. Il est donc très important de procéder à un dépistage systématique de la NSU chez les personnes atteintes d’une lésion de l’hémisphère droit. Les recherches ont démontré que l’hémisphère gauche module l’éveil et l’attention pour le champ visuel droit, alors que l’hémisphère droit contrôle ces processus dans les champs visuels droit et gauche. Cela peut expliquer en partie pourquoi la NSU n’est pas typique chez les personnes souffrant de lésions de l’hémisphère gauche ; l’hémisphère droit intact est capable de compenser les déficits perceptifs qui résultent de lésions de l’hémisphère gauche. Cela explique également pourquoi les personnes atteintes de lésions de l’hémisphère droit présentent des symptômes plus graves et plus persistants de NSU que celles atteintes de lésions de l’hémisphère gauche. Le Modèle du processus d’opposition fait valoir que chaque hémisphère s’occupe de l’hémisphère visuel controlatéral en inhibant l’autre hémisphère. Il poursuit en avançant qu’en cas de lésion de l’hémisphère droit, l’hémisphère gauche n’est pas inhibé, ce qui entraîne un déplacement exagéré de l’attention vers la droite (c’est-à-dire la NSU gauche). La NSU continue d’être couramment associée à un AVC à droite, mais les données de la littérature suggèrent que tous les patients ayant subi un AVC pourraient bénéficier d’un dépistage de la NSU.
La NSU peut-elle être traitée ?
Oui, vous trouverez ci-dessous un aperçu des quatre différents types de traitement qui existent pour USN :
- L’exploration visuelle : Pendant ce traitement, la personne présentant une NSU est encouragée à explorer le champ visuel négligé (en général le côté gauche) en exécutant une tâche de ce côté. Le traitement comprend souvent une cible visuelle que le patient utilise comme point de fixation pendant l’exploration.
- La stimulation sensorielle : Le thérapeute utilise différents types de stimulation sensorielle pour encourager la personne à faire attention à son côté négligé, entre autres :
- Les indices visuels/verbaux/auditifs : L’utilisation d’un indice visuel (p. ex. l’utilisation de ruban adhésif rouge ou de lumières clignotantes), d’un indice verbal (p. ex. la voix du thérapeute ou d’un membre de la famille) ou d’un indice auditif (p. ex. un avertisseur sonore ou une cloche) du côté négligé pour améliorer la prise de conscience de cet espace.
- Activation d’un membre : Quand il exécute ce traitement, le patient fait des mouvements avec le bras et la main affectés du côté négligé pour encourager l’exploration visuelle de cet espace (en général la main et le bras gauches vers la gauche). La personne recevant le traitement peut faire ces mouvements seule ou avec l’aide du thérapeute.
- Stimulation calorique : Ce traitement utilise de l’eau froide ou chaude que l’on met dans l’oreille du patient (canal de l’oreille externe) pour encourager l’exploration du côté négligé. L’eau froide semble encourager l’exploration vers l’oreille stimulée. L’eau chaude encourage l’exploration du champ opposé à l’oreille stimulée.
- Cache-œil/hémilunettes : Ce traitement utilise des lunettes standard avec la moitié des deux verres noircis du même côté (en général la moitié droite). Cela force le patient à regarder par le verre qui représente le côté qu’il néglige (en général le côté gauche).
- Prismes de Fresnel : Ce traitement implique de mettre des prismes sur des lunettes normales. Les prismes provoquent une déviation du champ visuel. Donc, s’il y a négligence du côté droit, ces prismes décaleront encore plus à droite ce que le patient voit à droite afin d’encourager l’exploration visuelle du champ visuel droit. Quand le patient porte ces lunettes pour la première fois, il n’atteint pas les objets du côté droit parce que sa vision est déviée vers la droite. Après des traitements répétés, les clients peuvent corriger la distance d’atteinte et peuvent saisir avec précision l’objet, en dépit de l’information visuelle déformée qu’ils reçoivent avec leurs lunettes.
- Vibrations ou stimulation nuque/main : Cette intervention consiste en l’utilisation de vibrations ou de stimulation sur la nuque ou la main du côté affecté par l’AVC pour encourager le patient à regarder de ce côté-là.
- Rotations du tronc : Cette stratégie implique des rotations volontaires du tronc vers le côté affecté par la NSU pour améliorer l’exploration visuelle de cet espace.
- Imagerie visuomotrice : L’imagerie visuelle implique des tâches d’imagerie mentale au cours desquelles le patient doit décrire les détails d’une pièce, d’un milieu ou d’une région géographique qui lui sont familiers. L’imagerie motrice consiste pour le patient à imaginer un mouvement corporel ou une posture et à décrire cette séquence. Ce type de traitement par imagerie peut stimuler les zones du cerveau qui peuvent activer ces mouvements réels pendant les activités de la vie quotidienne afin d’améliorer les symptômes de négligence.
- La Thérapie par contrainte induite du mouvement : Ce traitement implique de restreindre le bras qui n’est pas affecté par l’AVC (par exemple avec une écharpe) pour encourager l’utilisation du bras affecté par l’AVC. Tandis que cette intervention est utilisée surtout pour encourager l’utilisation du bras, elle encouragera aussi l’exploration visuelle du côté utilisé.
- Stimulation optocinétique : Observation de cibles visuelles mobiles de gauche à droite. Ce traitement est utilisé pour encourager l’exploration visuelle du côté qui est négligé.
- Rétroaction vidéo : Ce traitement implique de filmer le patient pendant qu’il exécute des activités spécifiques. Le thérapeute et le patient regardent ensuite le vidéo ensemble. Le thérapeute fait remarquer au client à quel point il néglige son corps ou l’espace d’un côté de son corps. Ils discutent ensuite des stratégies pour encourager l’attention vis-à-vis du corps du patient et de l’espace qu’il néglige.
- Thérapie pharmacologique : Ceci implique l’utilisation de médicaments spécifiques (médicaments agonistes de la dopamine) pour améliorer les compétences d’attention visuelle. Un médecin doit prescrire ces médicaments.
Quels sont les types de traitements les plus efficaces pour la NSU post-AVC ?
Les avantages des diverses interventions visant à traiter les symptômes de la NSU post-AVC ont été soigneusement étudiés.
| Type de traitement | Efficace (Oui/Non) | Niveau d’évidence |
| Prismes | Oui | Fort (1a) |
| Cache-œil | Oui | Limitée (2a) |
| Rotation du tronc | Oui | Limitée (2a) |
| Activation des membres | Oui | Limitée (2a) |
| Imagerie visuo-motrice | Oui | Limitée (2b) |
| Vibrations ou stimulation nuque/main | Oui | Consensus (3) |
| Stimulation calorique | Oui | Consensus (3) |
| Balayage visuel | Incertain | Contradictoire (4) |
| indices visuels/verbaux/auditifs | Non | Limitée (2a) |
| Stimulation optocinétique | Non | Limitée (2a) |
Les autres méthodes de traitement décrites dans la section ci-dessus, telles que la Thérapie par contrainte induite du mouvement, la rétroaction vidéo et la thérapie pharmacologique, nécessitent des recherches supplémentaires avant que leur efficacité puisse être confirmée.
Comment ces traitements de la NSU sont-ils administrés ?
Prismes de Fresnel :
Pour administrer la thérapie par prisme de Fresnel, le patient doit porter les prismes (qui dévient son champ visuel de 10º vers la droite) sur ses lunettes ou sur des lunettes de protection. Ensuite, le thérapeute doit engager le patient dans une tâche de balayage visuel où il doit pointer ou atteindre de manière répétitive deux cibles différentes situées de chaque côté de son champ de vision. Selon les études, l’intensité des répétitions varie de 30 à 100 par traitement. La fréquence du traitement varie également de 5 séances de 10 minutes sur 2 semaines, à deux traitements de 20 minutes par jour pendant 2 semaines ou 30 minutes de balayage effectué quotidiennement, 5 fois par semaine pendant 2 semaines.
Cache-œil :
Pour administrer un traitement utilisant un cache-œil, le thérapeute doit appliquer de demi-cache-œils droits sur les deux verres des lunettes du patient ou sur les lunettes de protection pour ceux qui ne portent pas de lunettes. Les patients doivent porter les lunettes pendant leurs heures d’éveil et pendant qu’ils effectuent toutes les tâches. La durée du traitement par cache-œil varie de 1 semaine à 3 mois avec des résultats améliorés selon la durée du port.
Rotation du tronc :
Les traitements de rotation du tronc nécessitent l’utilisation d’une orthèse thoracolombo-sacrée (par exemple, une Orthèse de Bon Saint Côme) à laquelle est fixée une barre métallique. La barre est conçue pour se projeter horizontalement vers l’avant, juste au-dessus de la tête du patient. Le thérapeute installe ensuite des cibles visuelles sur le côté négligé du patient et lui demande de faire tourner son corps de façon répétitive vers la cible et de la toucher avec la barre métallique. Cela encourage le balayage visuel de la zone négligée. Les mouvements peuvent être effectués en position assise ou debout. Dans l’étude portant sur l’efficacité de cette intervention, les patients ont reçu une heure de rotation du tronc par jour, chaque jour de la semaine pendant 1 mois (total de 20 heures).
Imagerie visuo-motrice :
En imagerie visuelle, le thérapeute guide le patient pour qu’il visualise mentalement des scènes qui favorisent le balayage de toutes les zones, y compris le côté négligé. Par exemple, le patient s’imagine qu’il s’agit d’un phare et que ses yeux sont la lumière qui balaie la zone environnante. Ou encore, le patient décrit une pièce ou une zone géographique spécifique. Pour les tâches d’imagerie motrice, le patient est invité à imaginer des postures spécifiques qu’il devra ensuite reproduire, ainsi que des séquences de mouvements spécifiques qui impliqueraient le bras droit suivi du bras gauche. L’intensité et la fréquence des traitements varient de trois séances de 30 minutes par semaine pendant une moyenne de 3 semaines à 40 essais de séances de 50 minutes.
Activation des membres :
Pour l’activation des membres, le thérapeute demande au patient de bouger activement son membre supérieur du côté négligé. Le thérapeute peut fournir des indices verbaux ou physiques pour guider le patient dans cette tâche. L’objectif est d’utiliser les mouvements volontaires actifs du membre supérieur pour favoriser le balayage de l’hémi-espace négligé. Par exemple, le patient peut soulever de manière répétitive une tige du côté gauche ou déplacer des cônes du côté droit vers le côté gauche. La fréquence recommandée de la thérapie d’activation des membres est de 1 heure par jour, pendant 10 jours sur une période de 2 semaines.
Balayage visuel :
Le traitement par balayage visuel implique un large éventail d’activités qui encouragent le patient à s’occuper de son côté négligé. Les thérapeutes peuvent amener les patients à lire, à copier, à décrire des figures ou des scènes, à effectuer des tâches informatiques (trouver des chiffres sur l’écran), etc. Toutes les études ont convenu d’une intensité et d’une fréquence de 1 heure de traitement par jour sur une base quotidienne (5 jours par semaine). Cependant, la durée varie entre 2, 4 ou 8 semaines de traitements. Les effets positifs des traitements de balayage visuel n’ont pas augmenté en fonction de la durée des traitements.
Quel est le meilleur moment pour recevoir des traitements pour la NSU ?
Les interventions pour la NSU peuvent être offertes pendant les phases aiguës, subaiguës et chroniques de récupération post-AVC.
Pour quel type de client le traitement pour la NSU est-il destiné ?
Les traitements pour la NSU peuvent être proposés aux personnes de tout âge, mais doivent être adaptés au niveau de fonctionnement spécifique du client. Les clients présentant des déficits cognitifs légers ou n’en présentant pas peuvent bénéficier de la thérapie (il est recommandé d’obtenir le score ≥22 sur le Mini-Mental State Examination) car ils doivent être capables de suivre des ordres simples. Les clients doivent avoir des capacités de langage réceptif afin de pouvoir comprendre les instructions ; toutefois, le langage expressif n’est pas une exigence. Enfin, les patients peuvent présenter d’autres déficiences visuelles post-AVC telles que l’hémianopsie et il est important de faire la différence entre les deux lors de l’évaluation des avantages du traitement.
Qui offre ces traitements ?
Les ergothérapeutes évaluent et traitent généralement les NSU dans un hôpital de soins aigus, un centre de réadaptation ou une clinique privée.
Considérations particulières pour les ergothérapeutes.
Les coûts d’équipement (par exemple, les thérapies par prisme, cache-œil ou activation des membres) et les formations nécessaires pour offrir les traitements pour la NSU sont minimes. Les thérapeutes doivent tenir compte du fait que les clients atteints de NSU peuvent être incapables de s’occuper d’un côté de leur corps (négligence personnelle), de l’espace à portée de main (négligence extra-personnelle de l’hémi-espace rapproché), de l’espace au-delà de la portée de main (négligence extra-personnelle de l’hémi-espace lointain) ou d’une combinaison de ces trois espaces dans leur environnement. Par conséquent, l’évaluation et le traitement pour la NSU au sein de ces hémisphères doivent être pris en compte. Il est également important d’expliquer au patient et à sa famille ce qu’est une NSU et de leur donner des recommandations de sécurité, comme de ne pas oublier de mettre le frein du fauteuil roulant du côté gauche et de veiller à ce que le patient ne trébuche pas sur des obstacles à gauche. Les thérapeutes peuvent également faire participer les membres de la famille à la thérapie en leur demandant de permettre au patient de chercher et de trouver des objets dans sa chambre qui sont situés du côté gauche au lieu de placer tous les objets dans le champ de vision du patient.
Procédures d’administration des outils d’évaluation.
Comb and Razor Test : Les patients doivent faire leur toilette à l’aide d’objets courants. Pour les hommes, cela consiste à se peigner et à se raser (rasoir avec protège lame) pendant 30 secondes chacun. Pour les femmes, il s’agit de se peigner et de faire une démonstration de l’utilisation d’un étui de poudre compacte pendant 30 secondes chacune. Pendant les 30 secondes, l’évaluateur classe par catégories chaque « coup » ou contact s’étant produit sur le côté gauche de la tête, le côté droit de la tête, ou comme ambigu.
Pour noter le test, les données d’observation sont intégrées dans une formule (% gauche = coups gauche/total des coups x 100), qui donne une valeur en %. Cette valeur indique dans quelle mesure la personne testée a négligé le côté gauche de sa tête. La négligence personnelle gauche est diagnostiquée lorsque le score moyen d’un individu en % gauche est inférieur à 35 %. Le test prend environ 5 minutes et ne nécessite aucune formation spécialisée pour l’administrer.
Test d’Albert : Les patients doivent rayer le centre de 41 lignes orientées au hasard, d’environ 2 cm de long chacune, disposées sur une feuille de papier. La feuille de test est présentée devant au patient à sa ligne médiane. L’examinateur demande au patient de rayer toutes les lignes et lui montre ce qui est requis en rayant lui-même les 5 lignes centrales. Le patient est encouragé à rayer toutes les lignes jusqu’à ce qu’il soit convaincu qu’elles le sont toutes.
La présence ou l’absence de NSU est basée sur le nombre de lignes non rayées de chaque côté de la feuille de test. Si certaines lignes ne sont pas rayées et que plus de 70 % des lignes non rayées se trouvent du même côté que la lésion cérébrale ou le déficit moteur, on soupçonne la présence de NSU. Ce résultat peut être quantifié en termes de pourcentage de lignes non rayées. Le test dure environ 5 minutes et ne nécessite aucune formation spécialisée pour l’administrer.
Baking Tray Task : Ce test exige que le patient prenne 16 « brioches » et les répartis aussi régulièrement que possible sur une planche de 75×100 cm. Des cubes peuvent être utilisés pour représenter les brioches. Le thérapeute doit noter comment les brioches sont étalées ; la présence de NSU peut être facilement détectée en fonction de leur disposition sur la planche (c’est-à-dire que si elles sont placées uniquement sur le côté droit de la planche, on suspecte une NSU gauche). Les patients ne dépassent généralement pas 3 à 5 minutes pour effectuer la tâche et aucune formation spécialisée n’est nécessaire pour administrer le test.
Balloons Test : Ce test développé pour détecter la présence de NSU contient 2 sous-tests. Le sous-test A demande au client de rayer les 22 ballons cibles des 202 cercles qui apparaissent sur une feuille, dans un délai fixé de 3 minutes. Dans le sous-test B, le nombre et la position des ballons sont exactement inversés par rapport au sous-test A, et il est demandé au client de rayer 10 cercles cibles des 90 ballons qui apparaissent sur une feuille, dans un délai fixé de 3 minutes. Aucune formation spécialisée n’est requise pour administrer le test.
Test des cloches : Dans ce test, le patient est invité à entourer avec un crayon les 35 cloches intégrées à 280 distracteurs (maisons, chevaux, etc.) sur une page de 11 x 8,5 pouces. Les objets sont en fait répartis de manière égale sur 7 colonnes contenant chacune 5 cibles et 40 distracteurs. Sur les 7 colonnes, 3 se trouvent sur le côté gauche de la feuille, 1 au milieu et 3 à droite. Pour administrer le test, l’examinateur doit s’asseoir face au patient et placer la page à la ligne médiane du patient. L’examinateur donne les instructions suivantes : « Votre tâche consistera à entourer avec le crayon toutes les cloches que vous trouverez sur la feuille que je placerai devant vous, sans perdre de temps. Vous commencerez quand je vous dirai « go » et vous arrêterez quand vous sentirez que vous avez encerclé toutes les cloches. Je vous demanderai également d’éviter de bouger ou de plier votre tronc si possible ». Si le patient s’arrête avant que toutes les cloches soient encerclées, l’examinateur ne donne qu’un seul avertissement en disant « êtes-vous sûr que toutes les cloches sont maintenant encerclées ? Vérifiez à nouveau ».
Pour noter le Test des cloches, le nombre total de cloches encerclées est enregistré ainsi que le temps nécessaire pour le compléter. La note maximale est de 35. Une omission de 6 cloches ou plus sur la moitié droite ou gauche de la page indique la présence de NSU. En jugeant de la répartition spatiale des cibles omises, l’évaluateur peut alors déterminer la gravité de la négligence visuelle et l’hémi-espace affecté (c’est-à-dire le gauche ou le droit).
Test de dessin d’horloge (TDH) : Il existe quelques variantes du TDH :
Dessin libre d’horloges : La personne reçoit une feuille de papier vierge et doit d’abord dessiner la forme d’une horloge, placer les chiffres sur l’horloge, puis dessiner les aiguilles pour indiquer une heure donnée. Pour mener à bien cette tâche, le patient doit d’abord dessiner le contour de l’horloge, puis placer les chiffres de 1 à 12 à l’intérieur, et enfin indiquer l’heure correcte en dessinant les aiguilles de l’horloge. Une horloge nettement anormale est une indication importante que l’individu peut avoir un déficit cognitif, justifiant un examen plus approfondi. ;
Horloge pré-dessinée : Certains cliniciens préfèrent fournir à l’individu un cercle pré-dessiné et le patient doit seulement placer les chiffres et les aiguilles sur le cadran de l’horloge.
Copier une horloge : La personne reçoit une horloge entièrement dessinée avec une certaine heure prédéfinie et est invitée à reproduire le dessin aussi fidèlement que possible. La réussite de la commande de copie nécessite moins d’utilisation du langage et des fonctions de mémoire, mais exige un recours plus important aux processus visuospatiaux et perceptifs.
Test de lecture d’horloge : Une version modifiée de la commande de copie du TDH demande simplement au patient de lire à haute voix l’heure indiquée sur une horloge dessinée par l’examinateur.
Le réglage « 11 heures et 10 minutes » en est un réglage idéal car il oblige le patient à utiliser toute l’horloge, mais aussi à décoder la commande « 10 minutes » afin d’indiquer le « 2 » sur l’horloge.
Les scores sont utilisés pour évaluer toute erreur ou distorsion, comme le fait de ne pas inclure des chiffres, de les placer au mauvais endroit ou d’avoir un espacement incorrect. Les systèmes de notation peuvent être simples ou complexes, de nature quantitative ou qualitative. Le TDH devrait durer environ 1 à 2 minutes et ne nécessite aucune formation spécialisée pour l’administrer.
Double Letter Cancellation Test (DLCT) : Le patient est invité à marquer toutes les lettres « C » et « E » sur une feuille de papier présentée 105 fois et contenant 6 lignes avec 52 lettres par ligne. Pour commencer le DLCT, le thérapeute place la feuille de test à la ligne médiane du patient, la fixe avec du ruban adhésif, et pointe vers la ligne d’essai en demandant au patient de marquer les « C » et les « E ». Si le patient n’est pas en mesure de réaliser l’essai, des instructions supplémentaires lui sont données. Si l’essai est correctement effectué, le thérapeute donne alors les instructions suivantes : « Regardez les lettres sur cette page. Mettez une ligne sur chaque « C » et « E ». Prêt, commencez ici ». Le thérapeute indique la première lettre de la première ligne. Le temps nécessaire pour terminer le test est enregistré.
Le score est calculé en soustrayant le nombre d’omissions (« C » et « E » non barrés) de la note parfaite possible de 105. Des scores plus élevés indiquent une meilleure performance. Le moment et le nombre total d’erreurs doivent être notés. Le test dure moins de 5 minutes et ne nécessite aucune formation spécialisée pour l’administrer.
Draw-A-Man Test : Ce test a été initialement conçu pour mesurer le niveau d’intelligence des enfants, mais il a démontré avoir une bonne fidélité pour détecter la NSU. Pour administrer le test, le thérapeute demande au patient de réaliser trois dessins individuels (dessiner un homme, une femme et soi-même) sur des feuilles de papier séparées. Aucune autre instruction n’est donnée. Il n’y a pas de bon ou mauvais type de dessin, bien que le patient doive à chaque fois dessiner une personne entière – c’est-à-dire de la tête aux pieds, et pas seulement le visage. Le test n’a pas de limite de temps, mais il est rare qu’une personne mette plus de 10 ou 15 minutes pour réaliser les trois dessins. Des instructions spécifiques pour la notation de la NSU figurent dans un article de Chen-Sea MJ. Validating the Draw-A-Man Test as a personal neglect test. Am J Occupy Therap. 2000 ;54 : 391–397.
Line Bisection Test : Il s’agit d’un test administré rapidement qui exige que le patient marque une ligne au centre d’une série de 17 lignes horizontales sur une page de 11x 8,5 pouces. Le test est noté en mesurant la déviation de la bissection (en centimètres ou millimètres) à partir du véritable centre de la ligne. Une déviation de plus de 6 mm par rapport au point médian indique la présence de NSU.
La plupart des testeurs utilisent une formule qui divise la déviation par la moitié de la longueur de la ligne, et multiplie ensuite ce quotient par 100 pour obtenir un pourcentage. L’omission de deux lignes ou plus sur une moitié de la page indique la présence de NSU. Ce test prend moins de 5 minutes et ne nécessite aucune formation spécialisée pour l’administrer.
Single Letter Cancellation Test : Le test comprend une feuille de papier de 8.5×11 contenant 6 lignes avec 52 lettres par ligne. La lettre de stimulation « H » est présentée 104 fois. La page est placée à la ligne médiane du patient. Le thérapeute demande au patient de mettre une ligne à travers chaque « H » qui se trouve sur la page. Le temps nécessaire pour effectuer le test est enregistré.
Le score est calculé en soustrayant le nombre d’omissions (les « H » qui n’ont pas été barrés) du score parfait possible de 104 (0 à 53 à gauche et 0 à 51 à droite). Des scores plus élevés indiquent un meilleur rendement. La présence de NSU peut être déduite en calculant la fréquence des erreurs à gauche ou à droite à partir du centre de la page. Des omissions de 4 ou plus sur un côté se sont avérées être pathologiques.
Star Cancellation Test : Dans ce test, le patient doit rayer, sur une feuille de papier, 56 petites étoiles qui sont intercalées avec 52 grandes étoiles, 13 lettres et 10 mots courts. Deux petites étoiles au centre sont utilisées pour la démonstration. Le thérapeute doit placer la page à la ligne médiane du patient.
Le score maximum qui peut être obtenu sur ce test est de 54 points (56 petites étoiles au total moins les 2 utilisées pour la démonstration). Un score seuil de < 44 indique la présence de NSU. Un indice de latéralité ou un ratio d’étoiles peut être calculé à partir du ratio d’étoiles annulées à gauche de la page par rapport au nombre total d’étoiles annulées. Des scores entre 0 et 0,46 indiquent la présence de NSU dans l’hémisphère gauche, tandis que les scores entre 0,54 et 1 indiquent la présence de NSU dans l’hémisphère droit. L’administration du test prend moins de 5 minutes et ne nécessite aucune formation spécialisée pour l’administrer.
National Institute of Health Stroke Scale (NIHSS) : Le NIHSS est une échelle de déficience à 15 items destinée à évaluer les résultats neurologiques et le degré de rétablissement de patients ayant subi un AVC. L’échelle évalue différents résultats, dont un item implique l’évaluation de la NSU de l’espace personnel et de l’hémi-espace extra-personnel rapproché. Il n’existe pas d’instructions spécifiques pour l’évaluation de la NSU, mais le test indique que des informations suffisantes pour détecter la négligence peuvent être obtenues en évaluant les items précédents et est noté de 0 à 2.
Short Version – Rivermead Behavioral Inattention Test (RBIT) : La version courte du RBIT comprend trois sous-tests habituels (franchissement de ligne, test d’annulation d’étoile et copie de figures) et cinq sous-tests comportementaux (balayage d’une image, lecture d’un menu, consommation d’un repas, lecture d’un article et tri des pièces de monnaie). Les procédures administratives et les méthodes de notation se trouvent dans le manuel RBIT.
Semi-Structured Scale for the Functional Evaluation of Hemi-inattention in Extrapersonal Space:
Les patients sont invités à effectuer différentes tâches avec des objets réels. Pour évaluer la négligence personnelle, les patients doivent démontrer l’utilisation de trois objets courants : peigne, rasoir/étui de poudre compacte et lunettes. Les objets sont placés un par un sur la ligne médiane du patient et celui-ci doit démontrer comment chacun d’eux est utilisé. Pour évaluer la négligence extra-personnelle, les patients doivent servir du thé, distribuer des cartes, décrire une image et décrire un environnement.
1. Servir du thé
Le patient est amené à une table avec un plateau contenant 4 tasses et soucoupes, une théière, un pot de sucre, des cuillères à thé et des serviettes en papier. Les examinateurs sont placés à la droite, en face et à la gauche du patient auquel il est demandé de servir du thé pour lui-même et pour ceux qui sont avec lui, de distribuer des serviettes et des cuillères à thé et également de servir le sucre. L’évaluateur qui est assis en face du patient demande : « Pourriez-vous servir le thé ? » Si le patient sert le thé, mais pas les serviettes de papier ou les cuillères à thé, l’examinateur demande : « Pourriez-vous me donner les cuillères à thé (serviettes de papier) ? »
2. Distribution de cartes
Les examinateurs et le patient s’assoient de la même façon que pour la situation de service de thé. Il est demandé au patient s’il sait comment jouer à la « Scopa ». Si nécessaire, on lui rappelle les règles de base (3 cartes pour chaque joueur et 4 cartes dans le milieu de la table).
Note : Puisque la Scopa est un jeu de cartes italien, d’autres jeux de cartes comportant 4 joueurs peuvent être utilisés à la place. L’examinateur assis en face du patient demande : « Pourriez-vous distribuer les cartes pour une partie de Scopa ? »
3. Description d’images
Une image est placée en face du patient et on lui demande : « Pourriez-vous décrire tout ce que vous voyez dans cette image ? ». Trois images sont utilisées. Deux images sont les cartes 3 et 6 (45 x 32 cm) de l’ensemble 1 du Progressive Picture Compositions de Byrne (1967) ; une image est la peinture « The dance on the ship » (60 X 100 cm) de Tissot. L’examinateur indique les personnages et les objets signalés par le patient par des numéros progressifs sur une photocopie de la figure de stimulus dans l’ordre dans lequel ils sont signalés, sans sollicitation d’aucune sorte. Lorsque la description est terminée, il est demandé au patient : « Bien, qu’est-ce que cette image représente ? » La réponse des patients est transcrite, mais ne contribue pas au score.
4. Description d’un environnement
Le patient est placé dans une pièce remplie d’objets sur les deux côtés (fauteuils, photos, lampes) et on lui demande de la décrire. On dit au patient : « Pourriez-vous décrire tout ce que vous voyez dans cette pièce ? » Pour faciliter la cotation, il est utile de noter les éléments décrits par le patient sur un schéma de l’environnement.
Info Pocket Booklet
Références
- Antonucci, G., Guariglia, C., Judica, A., Magnotti, L., Paolucci, S., Pizzamiglio, L., & Zoccolotti, P. (1995). Effectiveness of neglect rehabilitation in a randomized group study.Journal of Clinical and Experimental Neuropsychology, 17(3), 383-9. http://www.ncbi.nlm.nih.gov/pubmed/7650101
- Bailey, M.J., Riddoch, M.J., & Crome, P. (2002). Treatment of visual neglect in elderly patients with stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain.: a single-subject series using either a scanning and cueing strategy or a left-limb activation strategy.Physical Therapy, 82(8), 782-797. http://www.ncbi.nlm.nih.gov/pubmed/12147008 - Beis, J.M., A, J.M., Baumgarten, A., & Challier, B. (1999). Eye patching
A form of intervention that involves placing one right monocular patch or two right half-field patches on a pair of standard eyeglass frames. For persons with USN, eye patching conceals the visual field of the non-affected side in order to encourage visual scanning of the neglected hemispace.
in unilateral spatial neglect: Efficacy of two methods.Archives of Physical Medicine and Rehabilitation, 80, 71-6. http://www.ncbi.nlm.nih.gov/pubmed/9915375 - Cazzoli, D., Mur, R.M., Schumacher, R., von Arx, S., Chaves, S., Gutbrod, K., Bohlhalter, S., Bauer, D., Vanbellingen, T., Bertschi, M., Kipfer, S., Rosenthal, C.R., Kennard, C., Bassetti, C.L., & Nyffeler, T. (2012). Theta burst stimulation
3 bursts of transcranial magnetic stimulation at 50Hz and repeating at 5Hz at 80% of resting motor threshold.
reduces disability during the activitiesAs defined by the International Classification of Functioning, Disability and Health, activity is the performance of a task or action by an individual. Activity limitations are difficulties in performance of activities. These are also referred to as function.
of daily living in spatial neglect.Brain, 135, 3426-3439. http://www.ncbi.nlm.nih.gov/pubmed/22831781 - Dohle, C., Püllen, J., Nakaten, A., Küst, J., Rietz, C., & Karbe, H. (2009). Mirror therapy promotes recovery from severe hemiparesis: a randomized controlled trial. Neurorehabilitation and Neural Repair, 23, 209-217. http://www.ncbi.nlm.nih.gov/pubmed/19074686
- Fanthome, Y., Lincoln, N.B., Drummond, A., & Walker, M.F. (1995). The treatment of visual neglect using feedback of eye movements: a pilot study.Disability and Rehabilitation, 17(8), 413-417. http://www.ncbi.nlm.nih.gov/pubmed/8573702
- Ferreira, H.P., Lopes, M.A.L., Luiz, R.R., Cardosa, L., & Andre, C. (2011). Is visual scanning
During this intervention the person with USN is encouraged to conduct voluntary eye movements toward the neglected visual field (usually the left side) by performing a task in that hemispace. The treatment often includes a visual target that the patient uses as an anchor to direct voluntary gaze control while scanning.
better than mental practice in hemispatial neglect? Results from a pilot study.Topics in StrokeAlso called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. Rehabilitation, 18(2), 155-161. http://www.ncbi.nlm.nih.gov/pubmed/21447465 - Fong, K.N.K., Yang, N.Y.H., Chan, M.K.L., Chan, D.Y.L., Lau, A.F.C., Chan, D.Y.W., Cheung, J.T.Y., Cheung, H.K.Y., Chung, R.C.K., & Chan, C.C.H. (2013). Combined effects of sensory cueing and limb activation
A form of intervention that involves voluntary movement of the arm and hand. For persons with USN, voluntary movements of the affected upper extremity on the neglected side can encourage visual scanning and exploration of that hemispace.
on unilateral neglect in subacute left hemiplegic strokeAlso called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. patients: a randomized controlled pilot study.Clinical Rehabilitation, 27(7), 628-37. http://www.ncbi.nlm.nih.gov/pubmed/23405025 - Frassinetti, F., Angeli, V., Meneghello, F., Avanzi, S., & Ladavas, E. (2002). Long-lasting amelioration of visuospatial neglect by prism adaptation.Brain, 125, 608-623. http://www.ncbi.nlm.nih.gov/pubmed/11872617
- Harvey M., Hood B., North A., & Robertson I. (2003). The effects of visuomotor feedback training on the recovery of hemispatial neglect symptoms: assessment of a 2-week and follow-up intervention.Neuropsychologia, 41, 886-93. http://www.ncbi.nlm.nih.gov/pubmed/12667525
- Ianes, P., Varalta, V., Gandolfi, M., Picelli, A., Corno, M., Di Matteo, A., Fiaschi, A., & Smania, N. (2012). Stimulating visual exploration of the neglected space in the early stage of stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. by hemifield eye-patching: a randomized controlled trial in patients with right brain damage.European Journal of Physical Rehabilitation and Medicine, 48, 189-96. http://www.ncbi.nlm.nih.gov/pubmed/22083263 - Jo, K., Yu, J., & Jung, J. (2012). Effects of virtual reality-based rehabilitation on upper extremity function and visual perception in stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. patients: A randomized control trial.Journal of Physical Therapy Science, 24, 1205-1208. - Kalra, L., Perez, I., Gupta, S., & Wittink, M. (1997). The influence of visual neglect on stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. rehabilitation.Stroke Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain., 28(7), 1386-91. http://www.ncbi.nlm.nih.gov/pubmed/9227688 - Kamada, K., Shimodozono, M., Hamada, H., & Kawahira, K. (2011). Effects of 5 minutes of neck-muscle vibration immediately before occupational therapy on unilateral spatial neglect.Disability and Rehabilitation, 33(23-24), 2322-28. http://www.ncbi.nlm.nih.gov/pubmed/21486139
- Katz, N., Ring, H., Naveh, Y., Kizony, R., Feintuch, U., Weiss, P.L. (2005). Interactive virtual environment training for safe street crossing of right hemisphere stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. patients with Unilateral Spatial Neglect.Disability and Rehabilitation, 27(20), 1235-43. http://www.ncbi.nlm.nih.gov/pubmed/16298925 - Kerkhoff, G., Keller, I., Artinger, F., Hildebrandt, H., Marquardt, C., Reinhart, S., & Ziegler, W. (2012). Recovery from auditory and visual neglect after optokinetic stimulation
A form of intervention for USN that involves the observation of moving visual targets to encourage visual scanning of the neglected hemispace. A computer screen is typically used to display a leftward moving background of dots or strips in order to produce the illusions of visual stimuli being displaced to the right.
with pursuit eye movements – transient modulation and enduring treatment effects.Neuropsychologia, 50, 1164-1177. http://www.ncbi.nlm.nih.gov/pubmed/21964557 - Kim, B.R., Chun, M.H., Kim, D-Y., & Lee, S.J. (2013). Effect of high- and low-frequency repetitive transcranial magnetic stimulation on visuospatial neglect in patients with acute stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain.: a double-blind, sham-controlled trial.Archives of Physical Medicine and Rehabilitation, 94, 803-7. http://www.ncbi.nlm.nih.gov/pubmed/23298790 - Kim, Y.M., Chun, M.H., Yun, G.J., Song, Y.J., & Young, H.E. (2011). The effects of virtual reality training on unilateral spatial neglect in stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. patients.Annals of Rehabilitation Medicine, 35, 309-15. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3309210/ - Koch, G., Bonni S., Giacobbe, V., Bucchi, G., Basile, B., Lupo, F., Versace, V., Bozzali, M., & Caltagirone, C. (2012). Theta-burst stimulation of the left hemisphere accelerates recovery of hemispatial neglect.Neurology, 78, 24-30. http://www.ncbi.nlm.nih.gov/pubmed/22170878
- Ladavas, E., Menghini, G., & Umilta, C. (1994). A rehabilitation study of hemispatial neglect.Cognitive Neuropsychology, 11(1), 75-95. http://www.tandfonline.com/doi/abs/10.1080/02643299408251967#.VmCNJtIvfs0
- Luukkainen-Markkula, R., Tarkka, I.M., Pitkanen, K., Sivenius, J., & Hamalainen, H. (2009). Rehabilitation of hemispatial neglect: A randomized study using either arm activation or visual scanning
During this intervention the person with USN is encouraged to conduct voluntary eye movements toward the neglected visual field (usually the left side) by performing a task in that hemispace. The treatment often includes a visual target that the patient uses as an anchor to direct voluntary gaze control while scanning.
training.Restorative Neurology and Neuroscience, 27, 665-674. http://www.ncbi.nlm.nih.gov/pubmed/20042790 - Mancuso, M., Pacini, C., Gemignani, P., Bartalini, B., Agostini, B., Ferroni, L., Caputo M., Capitani, D., Mondin, E., & Cantagallo, A. (2012). Clinical application of prismatic lenses in the rehabilitation of neglect patients. A randomized controlled trial.European Journal of Physical Rehabilitation and Medicine, 48, 197-208. http://www.ncbi.nlm.nih.gov/pubmed/22318363
- Mizuno, K., Tsuji, T., Takebayashi, T., Fujiwara, T., Hase, K., & Liu, M. (2011). Prism adaptation therapy enhances rehabilitation of stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. patients with unilateral spatial neglect: a randomized, controlled trial.Neurorehabilitation and Neural Repair, 25(8), 711-20. http://www.ncbi.nlm.nih.gov/pubmed/21700922 - Modden, C., Behrens, M., Damke, I., Eilers, N., Kastrup, A., & Hildebrandt, H. (2012). A randomized controlled trial comparing 2 interventions for visual field loss with standard occupational therapy during inpatient stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. rehabilitation.Neurorehabilitation and Neural Repair, 26(5), 463-9. http://www.ncbi.nlm.nih.gov/pubmed/22140199 - Niemeier, J.P., Cifu, D.X., & Kishore, R. (2001). The lighthouse strategy: improving the functional status of patients with unilateral neglect after stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. and brain injury using a visual imagery intervention.Topics in Stroke Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. Rehabilitation, 8(2), 10-18. http://www.ncbi.nlm.nih.gov/pubmed/14523742 - Nijboer, T.C.W., Olthoff, L., Van der Stigchel, S., & Visser-Meily, J.M.A. (2014). Prism adaptation improves postural imbalance in neglect patients.NeuroReport, 25, 307-11. http://www.ncbi.nlm.nih.gov/pubmed/24488029
- Nys, G.M.S., De Haan, E.H.F., Kunneman, A., De Kort, P.L.M., & Dijkerman, H.C. (2008). Acute neglect rehabilitation using repetitive prism adaptation: A randomized placebo-controlled trial. Restorative Neurology and Neuroscience, 26(1), 1-12. http://www.ncbi.nlm.nih.gov/pubmed/18431002
- Osawa, A. & Maeshima, S. (2010). Family participation
As defined by the International Classification of Functioning, Disability and Health, participation is an individual's involvement in life situations in relation to health conditions, body functions or structures, activities, and contextual factors. Participation restrictions are problems an individual may have in the manner or extent of involvement in life situations. can improve unilateral spatial neglect in patients with acute right hemispheric stroke Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain..European Neurology, 63, 170-175. http://www.ncbi.nlm.nih.gov/pubmed/20185919 - Pandian, J.D., Arora, R., Kaur, P., Sharma, D., Vishwambaran, D.K., Arima, H. (2014). Mirror therapy in unilateral neglect after stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain..Neurology, 83, 1-6. http://www.ncbi.nlm.nih.gov/pubmed/25107877 - Paolucci, S., Antonucci, G., Guariglia, C., Magnotti, L., Pizzamiglio, L., & Zoccolutti, P. (1996). Facilitatory effect of neglect rehabilitation on the recovery of left hemiplegic stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. patients: a cross-over study.Journal of Neurology, 243, 308-14. http://www.ncbi.nlm.nih.gov/pubmed/8965102 - Pisella L, Rode G, Farnè A, Boisson D, Rossetti Y. (2002). Dissociated long lasting improvements of straight-ahead pointing and line bisection tasks in two hemineglect patients. Neuropsychologia.;40(3):327-34.http://www.ncbi.nlm.nih.gov/pubmed/11684165
- Pizzamiglio, L., Fasotti, L., Jehkonen, M., Antonucci, G., Magnotti, L., Boelen, D., & Sanna, A. (2004). The use of optokinetic stimulation
A form of intervention for USN that involves the observation of moving visual targets to encourage visual scanning of the neglected hemispace. A computer screen is typically used to display a leftward moving background of dots or strips in order to produce the illusions of visual stimuli being displaced to the right.
in rehabilitation of the hemineglect disorder.Cortex, 40, 441-450. http://www.ncbi.nlm.nih.gov/pubmed/15259325 - Polanowska, K., Seniow, J., Paprot, E., Lesniak, M., & Czlonkowska, A. (2009). Left-hand somatosensory stimulation combined with visual scanning
During this intervention the person with USN is encouraged to conduct voluntary eye movements toward the neglected visual field (usually the left side) by performing a task in that hemispace. The treatment often includes a visual target that the patient uses as an anchor to direct voluntary gaze control while scanning.
training in rehabilitation for post-stroke hemineglect: A randomised, double-blind study. Neuropsychological Rehabilitation, 19(3), 364-382. http://www.ncbi.nlm.nih.gov/pubmed/18663642 - Robertson, I.H., Gray, J.M., Pentland, B., & Waite, L.J. (1990). Microcomputer-based rehabilitation for unilateral left visual neglect: a randomized controlled trial.Archives of Physical Medicine and Rehabilitation, 71, 663-8. http://www.ncbi.nlm.nih.gov/pubmed/2375671
- Robertson, I.H., McMillan, T.M., MacLeod, E., Edgeworth, J., & Brock, D. (2002). Rehabilitation by limb activation
A form of intervention that involves voluntary movement of the arm and hand. For persons with USN, voluntary movements of the affected upper extremity on the neglected side can encourage visual scanning and exploration of that hemispace.
training reduces left-sided motor impairmentLoss of strength and coordination, decrease in arm or leg movement
in unilateral neglect patients: a single-blind randomised control trial.Neuropsychological Rehabilitation, 12(5), 439-54. http://www.tandfonline.com/doi/abs/10.1080/09602010244000228 - Rorsman, I. & Johansson, B. (2006). Can electro-acupuncture or transcutaneous nerve stimulation influence cognitive and emotional outcome after stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain.?Journal of Rehabilitation Medicine, 38, 13-19. http://www.ncbi.nlm.nih.gov/pubmed/16548081 - Rossetti, Y., Rode, G., Pisella, L., Farne, A., Boisson, D., & Perenin, M.T. (1998). Prism adaptation to a rightward optical deviation rehabilitates left hemispatial neglect.Nature, 395, 166-9. http://www.ncbi.nlm.nih.gov/pubmed/9744273
- Rossi, P.W., Kheyfets, S., & Reding, M.J. (1990). Fresnel prisms
A form of intervention that involves placing prisms over regular eyeglass frames, which result in a shift of the visual field so that visual targets appear deviated from their original position. When wearing the eye glasses patients initially reach toward the virtual position of the target due to their deviated vision. After repeated treatments with Fresnel prisms, patients can correct their visual positioning and will reach the actual target. For persons with USN, prisms may be used to encourage visual scanning of the neglected hemispace.
improve visual perception in strokeAlso called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. patients with homonymous hemianopia or unilateral visual neglect.Neurology, 40(10), 1597-9. http://www.ncbi.nlm.nih.gov/pubmed/2215953 - Schroder, A., Wist, E.R., & Homberg, V. (2008). TENS and optokinetic stimulation
A form of intervention for USN that involves the observation of moving visual targets to encourage visual scanning of the neglected hemispace. A computer screen is typically used to display a leftward moving background of dots or strips in order to produce the illusions of visual stimuli being displaced to the right.
in neglect therapy after cerebrovascular accident: A randomized controlled study.European Journal of Neurology, 15, 922-927. http://www.ncbi.nlm.nih.gov/pubmed/18637956 - Sedda, A., Borghese, N.A., Ronchetti, M., Mainetti, R., Pasotti, F., Beretta, G., & Bottini, G. (2013). Using virtual reality to rehabilitate neglect.Behavioral Neurology, 26, 183-185. http://www.ncbi.nlm.nih.gov/pubmed/22713415
- Serino, A., Barbiani, M., Rinaldesi, L., & Ladavas, E. (2009). Effectiveness of prism adaptation in neglect rehabilitation: A controlled trial study.Stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain., 40, 1-7. http://www.ncbi.nlm.nih.gov/pubmed/19246708 - Turton, A.J., O’Leary, K., Gabb, J., Woodward, R., & Gilchrist, I.D. (2010). A single blinded randomized controlled pilot trial of prism adaptation for improving self-care in stroke
Also called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. patients with neglect.Neuropsychological Rehabilitation, 20(2), 180-196. http://www.ncbi.nlm.nih.gov/pubmed/19629848 - van Kessel, M.E., Geurts, A.C.H., Brouwer, W.H., & Fasotti, L. (2013). Visual scanning
During this intervention the person with USN is encouraged to conduct voluntary eye movements toward the neglected visual field (usually the left side) by performing a task in that hemispace. The treatment often includes a visual target that the patient uses as an anchor to direct voluntary gaze control while scanning.
training for neglect after strokeAlso called a "brain attack" and happens when brain cells die because of inadequate blood flow. 20% of cases are a hemorrhage in the brain caused by a rupture or leakage from a blood vessel. 80% of cases are also know as a "schemic stroke", or the formation of a blood clot in a vessel supplying blood to the brain. with and without a computerized lane tracking dual task.Frontiers in Human Neuroscience, 7, 1-11. http://www.ncbi.nlm.nih.gov/pubmed/23847519 - Webster, J.S., McFarland, P.T., Rapport, L.J., Morrill, B., Roades, L.A., & Abadee, P.S. (2001). Computer-assisted training for improving wheelchair mobility in unilateral neglect patients.Archives of Physical Medicine and Rehabilitation, 82, 769-75. http://www.ncbi.nlm.nih.gov/pubmed/11387581
- Weinberg, J., Diller, L., Gordon, W.A., et al. (1977). Visual scanning
During this intervention the person with USN is encouraged to conduct voluntary eye movements toward the neglected visual field (usually the left side) by performing a task in that hemispace. The treatment often includes a visual target that the patient uses as an anchor to direct voluntary gaze control while scanning.
training effect on reading-related in acquired right brain damage.Archives of Physical Medicine and Rehabilitation, 58, 479-86. http://www.ncbi.nlm.nih.gov/pubmed/931586 - Weinberg, J., Diller, L., Gordon, W.A., et al. (1979). Training sensory awareness and spatial organization in people with right brain damage.Archives of Physical Medicine and Rehabilitation, 60, 491-6. http://www.ncbi.nlm.nih.gov/pubmed/508074
- Wiart, L., Bon Saint Come, A., Debelleix, X., Petit, H., Joseph, P.A., Mazaux, J.M., & Barat, M. (1997). Unilateral neglect syndrom rehabilitation by trunk rotation
A form of intervention that involves actively twisting the body's trunk towards the affected side. This can also be performed passively by means of a shoulder strap or corset. For persons experiencing USN, trunk rotation may be used to improve visual scanning and exploration of the neglected hemispace.
and scanning training.Archives of Physical Medicine and Rehabilitation, 78(4), 424-9. http://www.ncbi.nlm.nih.gov/pubmed/9111464 - Zeloni, G., Farne, A., & Baccini, M. (2002). Viewing less to see better.Journal of Neurology, Neurosurgery and Psychiatry, 73(2), 195-8. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1737996/
Études exclues :
Castiello, U., Lusher, D., Burton, C., et al. (2004). Improving left hemispatial neglect using virtual reality. Neurology, 62, 1958-62.
Motif d’exclusion : Étude de faisabilité.
Dick, A. S., Raja Beharelle, A., Solodkin, A., & Small, S. L. (2013). Interhemispheric functional connectivity following prenatal or perinatal brain injury predicts receptive language outcome. J Neurosci., 33(13), 5612-5625.
Motif d’exclusion : Les participants de l’étude sont des enfants.
Ertekin, A., Gelecek, N., Yildirim, Y., & Akdal, G. (2009). Supervised versus home physiotherapy outcomes in stroke patients with unilateral visual neglect: a randomized controlled follow-up study. Journal of Neurological Sciences, 26 (3), 325-34.
Motif d’exclusion : Les deux groupes ont reçu le même programme d’exercices pour cibler la NSU, qui a ensuite été exécuté sous supervision ou comme programme à domicile.
Hommel, M., Peres, B., Pollak, P., Memin, B., Besson, G., Gaio, J.M., & Perret, J. (1990). Effects of passive tactile and auditory stimuli on left visual neglect. Archives of Neurology, 47, 573-576.
Motif d’exclusion : Aucun groupe témoin.
Kim, J., Kim, K., Kim, D.Y., Chang, W.H., Park, C., Ohn, S.H., Han, K., Ku, J., Nam, S.W., Kim, I.Y., & Kim, S.I. (2007). Virtual reality training system for rehabilitation of stroke patients with unilateral neglect: crossing the virtual street. CyberPsychology & Behavior, 10(1), 7-15.
Motif d’exclusion : Étude de faisabilité.
Tham, K. & Tegner, R. (1997). Video feedback in the rehabilitation of patients with unilateral neglect. Archives of Physical Medicine and Rehabilitation, 78, 410-413.
Motif d’exclusion : Les deux groupes ont reçu une rétroaction sensorielle (rétroaction verbale vs rétroaction visuelle).
Trislin, I., Dupierriz, E., Chokron, S., Coquillart, S., & Ohlmann, T. (2009). Uses of virtual reality for diagnosis, rehabilitation and study of unilateral spatial neglect: review and analysis. CyberPsychology & Behavior, 12(2), 175-81.
Motif d’exclusion : Revue.
Walker, R., Young, A.W., & Lincoln, N.B. (1996). Eye patching and the rehabilitation of visual neglect. Neuropsychological Rehabilitation, 6(3), 219-231.
Motif d’exclusion : Aucun groupe témoin.